En enero de este año, un trabajador norteamericano de mantenimiento gravemente enfermo por insuficiencia cardíaca llamado David Bennett, de 57 años, ocupó los titulares de todo el mundo al someterse a una cirugía que hizo historia: el primer xenotrasplante con un órgano de cerdo realizado a un ser humano (que no tuviera muerte cerebral). Los cirujanos reemplazaron su corazón debilitado por uno de cerdo modificado genéticamente. Bennett vivió durante 60 días, 50 de los cuales el órgano funcionó incluso mejor de lo que se esperaba, hasta que sus otras múltiples afecciones le causaron la muerte. Pero la intervención mostró por primera vez que un corazón de cerdo puede mantener con vida a un ser humano.
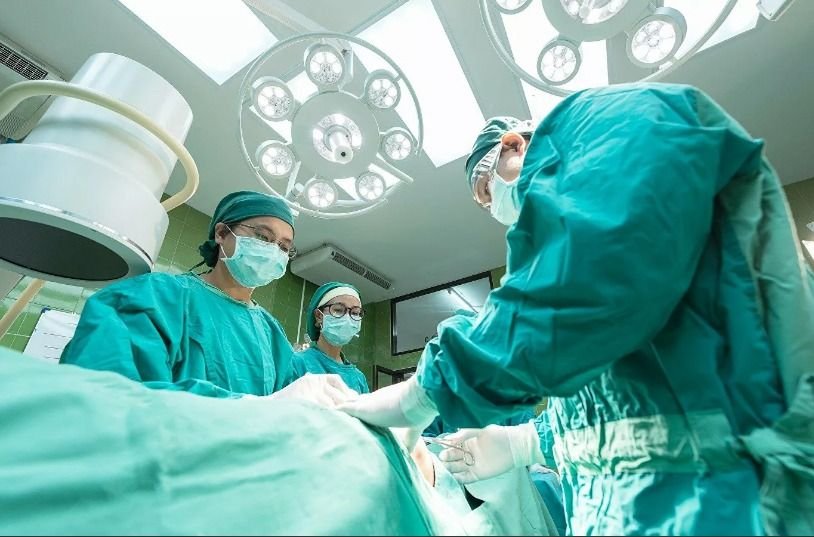
Aunque la idea de utilizar órganos porcinos para paliar el grave déficit de corazones y riñones para trasplante no es nueva, hasta ahora la tecnología indispensable no había alcanzado la madurez. Sin embargo, un grupo de investigadores de la Universidad de San Martín (Unsam), en colaboración con colegas europeos, y con médicos, veterinarios y productores agropecuarios locales están avanzando en un proyecto que prevé producir los primeros cerdos modificados para xenotrasplantes en alrededor de un año y medio. Es más, este mes están empezando a producir los embriones que serán implantados en animales estrictamente controlados.
“Tenemos todas las patas del proyecto cubiertas, porque no hay que olvidar que en este tipo de iniciativas no solo tiene que haber científicos, sino médicos, trasplantólogos –cuenta Adrián Mutto, investigador del Instituto de Investigaciones Biotecnológicas de la Unsam con vasta experiencia en clonación de mamíferos y transgénesis, y líder de la iniciativa–. Uno de ellos es Adrián Abalovich, miembro de la Sociedad Argentina de Trasplantes, jefe de emergencias del Hospital Eva Perón, de San Martín y coordinador de la Comisión de Xenotransplantes de la Sociedad Argentina de Trasplantes (SAT)”.
El equipo también firmará convenios de cooperación con la Fundación Favaloro, con el Cemic y con el Instituto de Trasplantes de Alta Complejidad (ITAC). Ellos aportarán profesionales y material quirúrgico para los ensayos preclínicos de trasplante de riñón y corazón.
“Aproximadamente en el término de un año y medio esperamos tener los primeros órganos de cerdo –detalla Mutto–. La Secretaría de Agricultura, Ganadería y Pesca, del Ministerio de Economía, junto con la Anmat están armando un detallado sistema regulatorio que va desde la producción de los embriones hasta la obtención del órgano para trasplante en humanos”.
El grupo ya cuenta con inversores norteamericanos interesados en completar la primera etapa, que es la generación de cerdos genéticamente editados y con el asesoramiento de Joachim Denner, considerado el virólogo más importante del mundo en esta especie. Este profesor del Instituto Robert Koch, de Berlín, será el encargado de analizar las líneas embrionarias y certificar que están absolutamente libres de retrovirus endógenos recombinantes porcinos, como el PERV C, y los cerdos, libres de gérmenes patógenos para el ser humano.
Los animales se obtendrán por clonación [introduciendo el núcleo de una célula madre en un ovocito], un proceso complejo y engorroso. Si bien la técnica no cambió en lo sustancial a lo largo de los últimos 25 años, se fueron haciendo ajustes de “sintonía fina” que permitieron hacerla más eficiente.
“Esto no se trata simplemente de generar un cerdo en el laboratorio –aclara Mutto–. Va muchísimo más allá. Por ejemplo, para avanzar, necesitábamos un productor de cerdos. Entonces, Isowean, uno de los mayores de la Argentina, nos prestó toda la ‘genética’: biopsias de piel y de médula a partir de las cuales hacemos cultivos de células madre”.
También se necesitan ovocitos [óvulos] porcinos, para lo cual se asociaron con el frigorífico Campo Austral, de San Antonio de Areco, que les proporciona ovarios de las hembras que se utilizan para consumo humano. Para producir los embriones, a los que se les retiran genes porcinos negativos para el ser humano y se les insertan genes humanos que regulan la activación del sistema inmune (específicamente, para disminuir el rechazo), los científicos utilizan células de piel [fibroblastos, que se encuentran en el tejido conectivo] y mesenquimales [células madre multipotenciales que se pueden diferenciar en diversos tejidos, y actúan en la regeneración o reparación de tejidos dañados].
Tienen dos vías posibles para realizar las modificaciones genéticas necesarias: una es usar estas células mesenquimales y hacer los cambios utilizando la técnica CRISPR [de tijeras moleculares, que permiten eliminar o insertar genes]. La otra es generar líneas estables de células madres embrionarias a partir de embriones editados, y esas células madres modificarlas después y utilizarlas como células donantes finales.
“Ahora se sabe que la clonación funciona mucho mejor con células madre mesenquimales que con fibroblastos –destaca Mutto–, pero por las dudas tomamos de ambos tipos, y que provengan de individuos con sangre grupo 0 (para eliminar una posible causa de rechazo agudo, que es lo que uno trata de evitar) y las enviamos a Berlín donde les aplican baterías de tests para detectar unos 45 virus y patógenos propios de los cerdos. Como decía mi director de tesis y padre científico, Rodolfo Ugalde, practicamos la ciencia del sentido común: si uno tiene la posibilidad de evitar todo riesgo desde el principio, hay que empezar por eso, porque así podremos asegurar que el órgano que obtengamos estará completamente apto para el trasplante”.
Otro paso delicado es la transferencia e implantación de los embriones. Para mejorar las chances de éxito, con los científicos de la Unsam colaboran dos veterinarios especialistas en reproducción de cerdos y tienen previsto construir infraestructura especial para la crianza de animales libres de patógenos. Será un ambiente estéril, con aire y agua filtrados, escrupuloso control de la alimentación y de los efluentes, que en la primera etapa albergará hasta 40 madres y, de acuerdo con el avance el proyecto, podría escalarse.
“Calculamos que de cada 100 ovocitos obtendremos entre dos y tres cerdos –detalla Mutto– .Una vez que tengamos animales modificados, podremos cruzarlos en forma natural, porque los hijos heredarán las mutaciones y las inserciones que se les hayan realizado de acuerdo con las leyes de Mendel”.
Además de generar animales donantes de órganos, los investigadores aspiran a montar una plataforma tecnológica capaz de ofrecer otros servicios, como servir de modelo de enfermedades humanas, para obtener líneas de células madres embrionarias para testeo de hormonas y drogas, ensayo de productos cosméticos, para el desarrollo de carne artificial... Y no descartan incursionar en la bioimpresión en 3D [para la creación de órganos humanos en el laboratorio]. “Eso todavía está lejos –opina el científico–. No sé cuánto tardaremos, pero va a ocurrir”.
“Este grupo quiere desarrollar soluciones para problemas de salud vinculados con la insuficiencia de órganos y tejidos –coincide Abalovich–. Si bien hoy el objetivo principal es el xenotrasplante, no es el único. El día de mañana podemos desarrollar otras alternativas, como la generación de órganos a partir de células madres del propio individuo mediante ingeniería de tejidos”.
Y aclara que aunque en este caso están copiando modelos que surgieron en el extranjero, dominar esta tecnología es fundamental para tener independencia. “Los países del Primer Mundo están haciendo punta, pero la Argentina tiene una historia importante en este campo –cuenta–: el segundo ensayo regulado de xenotrasplante de islotes pancreáticos del mundo se hizo en un hospital público local. Tenemos antecedentes y los grupos más importantes en xenotrasplante lo reconocen”.
En la actualidad, solo un puñado de equipos están realizando estos desarrollos biotecnológicos. “Dos en los Estados Unidos, uno en Corea del Sur, otro en China y no muchos más –subraya Abalovich–. Estar dentro de los menos de diez países que están trabajando en esto es fruto de que llevamos muchos años en la investigación en edición genética y pudimos nuclear a un grupo de expertos que le da solidez a la iniciativa”.
Los científicos ya presentaron los documentos a la Conabia y al Comité Institucional para el Cuidado y Uso de Animales de Experimentación (Cicuae). Una vez obtenidos los primeros embriones, se envían a secuenciar y analizar, para luego transferirlos a cerdas. “Después, hay que esperar tres meses, tres semanas y tres días –se entusiasma Mutto–. Aunque por lo general tienen entre 9 y 14 lechoncitos, al haberlos producido por clonación, muy probablemente tengamos menos”.
En la Facultad de Agronomía y Veterinaria, Daniel Salamone y su equipo también están investigando en este tema y crearon una compañía llamada New Organs Biotech con la que desarrollaron más de 100 embriones y los están implantando, aunque todavía sin éxito.
En la Argentina, hay alrededor de 30.000 pacientes en diálisis, de los cuales solo el 40% sobrevive más de cinco años. Se calcula que unas 6000 personas están en lista de espera para un trasplante de riñón. Al mismo tiempo, solo en China se sacrifican anualmente varios cientos de millones de cerdos para consumo humano.












 Cerrar sesión
Cerrar sesión