Cuando hace más de tres décadas y siendo todavía un estudiante, el científico argentino Gabriel Rabinovich identificó la galectina-1 (Gal-1) en nuestro sistema inmunológico, jamás imaginó que había dado con una llave maestra de algunas de las patologías que más nos afligen, como el cáncer y las enfermedades autoinmunes. Sin embargo, esa molécula que a lo largo de todo este tiempo estudió y caracterizó con su equipo hasta convertirse en un referente mundial en esta área de investigación, sigue agregando roles cruciales en el desarrollo de distintos tumores. Ahora, un trabajo que acaba de publicarse en Science Traslational Medicine y que es fruto de una colaboración con dos grupos de la Universidad de Oxford, en el Reino Unido, muestra que a los cánceres ya identificados suma otro en el que también juega un papel protagónico: una neoplasia de la sangre llamada mielofibrosis (https://doi.org/10.1126/scitranslmed.adj7552).
Este cáncer hematológico se desencadena a partir de una mutación en las células progenitoras de la médula ósea, la “fábrica” donde se generan los distintos glóbulos sanguíneos. Los investigadores descubrieron que la Gal-1 no solo actúa como moduladora de la inflamación, de modo que podría ser un blanco para futuras terapias, sino que además sería un biomarcador de la progresión que permite predecir el avance de la patología.
“Este trabajo me produjo un placer especial –cuenta Rabinovich, investigador superior del Conicet, director del Laboratorio de Glicomedicina del Instituto de Biología y Medicina Experimental (Ibyme) y profesor titular plenario de la Facultad de Ciencias Exactas y Naturales de la UBA–. Lo iniciaron Betham Psaila y Adam Mead. Ellos trabajan en dos laboratorios en la Universidad de Oxford y son expertos mundiales en esta enfermedad, un cáncer de las células progenitoras de la médula ósea causado por tres mutaciones diferentes. Juan Manuel Pérez Saez fue el protagonista científico por parte de nuestro laboratorio”.
MÁS INFO
En ciertos pacientes que tienen alguna de estas mutaciones, la enfermedad es relativamente benigna. Pero en otros, no se sabe porqué, progresa hacia una neoplasia [crecimiento descontrolado de células o tejidos anormales]. Es una enfermedad que tiene muy pocas alternativas terapéuticas y en la que además se carece de un marcador que indique cuándo se va a malignizar, invadiendo gradualmente la médula ósea e impidiendo la normal producción de células sanguíneas.
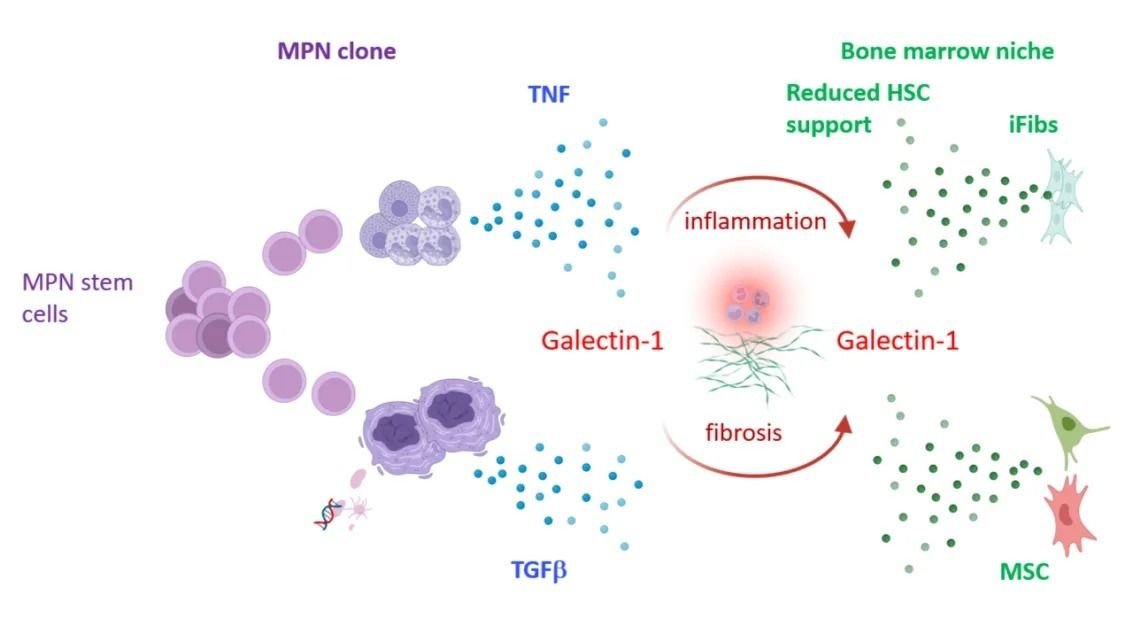
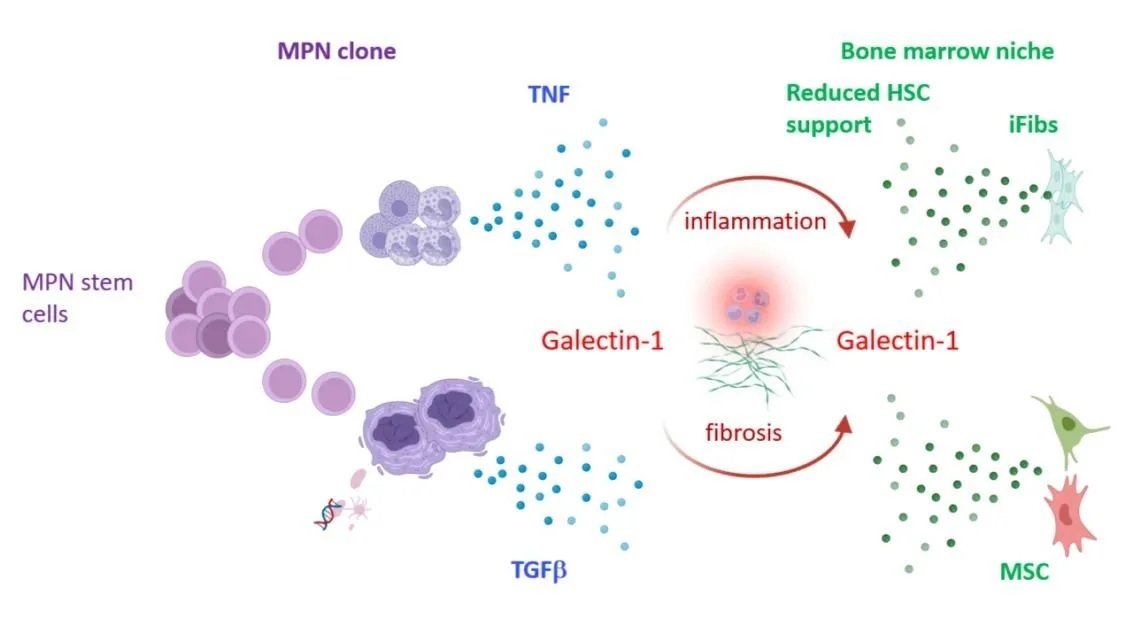
“Todos los glóbulos sanguíneos se generan a través de una célula madre progenitora –explica el inmunólogo, que el año pasado fundó Galtec, una compañía cuyo objetivo es desarrollar productos terapéuticos que modulen la actividad de Gal-1; es decir, que aumenten o bloqueen su expresión (la “enciendan” o la “apaguen”) para así manipular el funcionamiento del sistema inmune frente a distintas patologías–. Es la que da lugar a los progenitores mieloides, que por un lado generan los megacariocitos (progenitores de las plaquetas) y por otro, a los granulocitos/neutrófilos y monocitos/macrófagos (nuestras células ‘presentadoras’ del sistema inmune), y a los glóbulos rojos [eritrocitos]. Esa célula madre progenitora de la médula ósea va adquiriendo mutaciones durante la vida (es decir, que no son hereditarias). Hay tres que caracterizan la enfermedad; la única terapia disponible en este momento inhibe una sola de ellas y no tiene un impacto sobre todos los aspectos de la enfermedad”.
La evolución de la enfermedad es muy lenta, porque aunque la persona haya adquirido la mutación en su juventud, por lo general se manifiesta después de los 65 años, cuando empieza a generarse una inflamación típica de la edad. Y es esa inflamación la que conduce a la fibrosis: la médula se llena de fibras, de colágeno, los fibroblastos [células que contribuyen a la formación de tejido conectivo] empiezan a ocupar la médula y a generar cicatrices, lo que impide que se produzcan una buena cantidad de glóbulos blancos, rojos, eritrocitos y plaquetas. En general se presenta con anemia, porque el paciente no tiene buenos glóbulos rojos, y también hematopoyesis extramedular; es decir, que otros órganos reemplazan a la médula en el proceso de formación, desarrollo y maduración de los componentes de la sangre. “Las personas empiezan a tener un bazo muy agrandado (un cuadro conocido como esplenomegalia), porque se ocupan de hacer lo que no puede hacer la médula –destaca Rabinovich–. También pueden padecer muchas otras patologías, presentan problemas para defenderse frente a los patógenos por las alteraciones en los glóbulos blancos, y trastornos de coagulación por alteraciones en las plaquetas… Se desconoce porqué en algunos pacientes el pronóstico es más benigno que en otros”.
El recurso farmacológico con que se cuenta hasta el momento impacta sobre una sola mutación y tiene un efecto limitado sobre la regulación de la enfermedad. Entonces, lo que hicieron Psaila y Mead fue cartografiar la médula de un paciente con mielofibrosis y compararla con la de una persona sana y con otra con una patología diferente, pero con características similares. Y lo hicieron con distintas estrategias. “Desarrollaron un modelo animal que recapitula lo que sucede en el humano, pero también tomaron muestras de pacientes que tenían mielofibrosis causada por las distintas mutaciones que se pueden presentar en la enfermedad, e hicieron análisis bioinformáticos –explica el investigador–. Lo más destacable del trabajo es que tiene aproximaciones muy diversas y emplearon enfoques muy modernos, como hacer single-cell transcriptomics (transcriptómica a simple célula) que permite hacer una disección de cuáles son las células que generan ese escenario tan inflamatorio y tan fibrótico en la médula. Es una estrategia (nosotros la montamos en el laboratorio) que permite ver no solamente qué células participan en este proceso de manera protagónica, sino también cuáles son los mediadores [las moléculas que influyen, a través de sus correspondientes receptores, en una zona cercana a aquella en la que fueron sintetizadas y liberadas]. De ese modo uno puede encontrar nuevas terapias”.
Así, identificaron cuatro células que son las responsables de orquestar esta inflamación: un tipo de fibroblastos, los basófilos [que participan en las alergias], los mastocitos [que tienen una función importante en la respuesta inmunitaria] y los megacariocitos, que son los progenitores de las plaquetas. Y por vía informática pudieron predecir cuál era la mediadora, la proteína que regula este cuarteto de células que diferenciaban la médula de un paciente mielofibrótico de uno normal. Así… ¡eureka! Hallaron que esa llave maestra es la Gal-1, que también tiene un rol crucial en otros cánceres, como el de colon o el melanoma [de piel], y en enfermedades autoinmunes.
Tras este hallazgo, los científicos británicos inmediatamente se pusieron en contacto con Rabinovich. “Cuando nos convocaron, les ofrecimos nuestros desarrollos, particularmente, inhibidores de Gal-1 (nuestros anticuerpos monoclonales neutralizantes), la proteína Gal-1 recombinante [obtenida en el laboratorio] y otros reactivos para modulación in vitro e in vivo –cuenta–. Gracias a un acuerdo legal de transferencia de material les facilitamos también nuestro anticuerpo monoclonal [para modularla]. Una de las cosas más hermosas es que ellos lo validaron, y esto muestra que no solo funciona en nuestras manos, sino también en las de otros que tienen una enorme experiencia”.
Y más aún: en modelos animales e in vitro, funciona con un nivel de eficacia que es igual a superior a la terapia disponible: revierte la fibrosis cuando ya está establecida.
“Nosotros habíamos visto [en la Gal-1] efectos inmunoestimulantes, efectos antiangiogénicos [inhibe la formación de nuevos vasos sanguíneos], pero nunca habíamos visto nada relacionado con la fibrosis. Esto agrega un efecto diferente y también beneficioso, y amplía muchísimo nuestro horizonte. Logra hacer retornar los glóbulos rojos y plaquetas a valores normales”, agrega.
Pero eso no es todo. En la última parte del paper postulan que además de ser un posible blanco terapéutico, tiene valor pronóstico: a un paciente recién diagnosticado se le pueden medir sus valores de Gal-1 y a partir de ellos tener un pronóstico de la enfermedad.
“Me parece un hallazgo extraordinario por varias razones –opina el oncólogo Ernesto Gil Deza, director de investigación y docencia del Instituto Henry Moore, de Buenos Aires–: en primer lugar, dilucida la relación entre estados proinflamatorios y mielofibrosis, agrega un factor diagnóstico predictivo en los casos dudosos o precoces pues la activación de esta via predice el curso hacia la fibrosis, y muestra la eficacia en ratones del tratamiento con anticuerpos antigalectina. Adicionalmente, tenemos en nuestro país al mayor experto del mundo en galectina y cáncer. Es bueno para la ciencia y excelente para nuestro país”.
“El trabajo es buenísimo, súper completo –coincide la biotecnóloga del Conicet Florencia Cayrol, distinguida con el premio L’Oréal-Unesco por las Mujeres en la Ciencia en la categoría ‘talento joven’ y recientemente galardonada con el Global Research Award de la Sociedad Norteamericana de Hematología–. Estudian patologías de origen mieloide, una neoplasia hematológica para la que, como ocurre con varias otras, no hay terapias específicas, porque no hay marcadores, no se conoce cómo se generan. Analizan muy en profundidad cuáles son las poblaciones celulares de la médula de ratones con esta patología que interactúan y que más relevancia tienen. Y lo más interesante es que encuentran que la Gal-1 es un biomarcador [que permite inferir cuál será] la progresión que tendrá la enfermedad. Esto es importante porque algunos pacientes pueden presentar una forma relativamente leve y convivir con la patología, pero en otros progresa y no tiene buen pronóstico. Además, la proponen como blanco terapéutico y demuestran en modelos animales cómo el inhibidor antigalectina-1 desarrollado por Gabriel inhibe el crecimiento y lo validan en muestras de pacientes. Es un avance espectacular”.
Gracias a la creación de Galtec, cuyos futuros productos ya están protegidos por dos familias de patentes (11 en total que los cubren en los Estados Unidos, Reino Unido, Europa, Japón, Brasil, Canadá y la Argentina) que les otorgarán importantes regalías al Conicet, a la Fundación Sales y a los inventores ante cada hito que se vaya alcanzando, la transferencia del anticuerpo neutralizante antigalectina-1 ya está más cerana y esperan poder incorporar distintas patologías en los ensayos clínicos. “Estamos viendo cómo seguir colaborando con Psaila y Mead –cuenta Rabinovich–. Ellos creen en nuestra terapia y yo siento una gran satisfacción de que hayan podido validar el anticuerpo, que pudieron confirmar a Gal-1 como blanco terapéutico y como biomarcador con valor pronóstico, y que cada vez se va ampliando más el espectro de patologías en las cuales podría ser útil esta molécula”.
“Este estudio es un ejemplo brillante del poder de la colaboración en la ciencia, tanto entre instituciones académicas como entre investigadores y médicos –afirma una de las líderes de este estudio, Bethan Psaila, en un comunicado de la Universidad de Oxford–. No hubiéramos podido completar este trabajo sin el apoyo, los recursos y la experiencia de nuestros amigos y colegas internacionales, y la participación de pacientes que no solo donan sus muestras para la investigación, sino que también nos ayudan a establecer nuestras prioridades de investigación”.
Si bien tuvo varias posibilidades de realizar estudios posdoctorales en el exterior, Rabinovich decidió seguir trabajando en la Argentina. En 1999, defendió su tesis y se trasladó desde su Córdoba natal a Buenos Aires, donde comenzó a trabajar en el Hospital de Clínicas. Durante una pasantía con su profesor Carlos Landa y luego en su doctorado con la profesora Clelia Riera había logrado identificar esta proteína en el sistema inmune. En 2004 publicó un trabajo pionero y después vinieron un sinnúmero de hitos científicos. Dirigió 29 tesis doctorales. En total, lleva publicados con su firma más de 320 trabajos que recibieron 40.000 citaciones. En 2019, fue reconocido por la revista Immunity como una de las "25 voces líderes" para delinear el futuro de la inmunología y en 2024 la revista Cell lo eligió como "científico líder" por su 50° aniversario.













 Cerrar sesión
Cerrar sesión